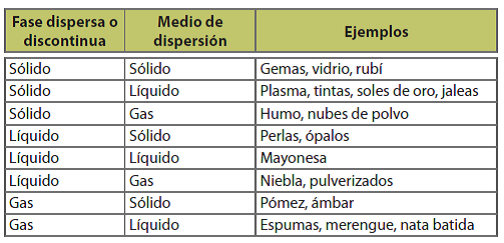
- SOLUCIONES QUÍMICASTodos estamos en contacto diario con las soluciones químicas (jugos, refrescos, café, rio, mar, etc.). Y las plantas también, cuando sus raíces contactan la solución del suelo.Cuando se introduce un poquito de azúcar dentro de un vaso lleno de agua, se observa que la azúcar desaparece sin dejar rastro de su presencia en el agua. Lo primero que se piensa es que hubo una combinación química, es decir, que las dos sustancias reaccionaron químicamente, lo que significa que hubo un reacomodo entre sus átomos. Sin embargo, simplemente sucedió que ambas sustancias se combinaron físicamente y formaron una mezcla homogénea o solución.A la unión de dos o más sustancias se le conoce como combinación; estas combinaciones pue- den ser de dos tipos: combinaciones físicas y combinaciones químicas. Las combinaciones quími cas se conocen como enlaces químicos; estas combinaciones consisten en la unión de dos o más sustancias, cuyos átomos o moléculas se unen entre sí mediante fuerzas llamadas enlaces quími cos, y sólo mediante procedimientos químicos es posible separar tales sustancias combinadas; por ejemplo, al combinar agua (H2O) con cal viva (CaO), entonces se forma el Hidróxido de Cal cio. Aquí hubo una combinación química, puesto que los átomos del agua y la cal se reacomoda- ron originando así el Hidróxido de Calcio.

- Concentradas: en sustancias como estas, la cantidad de soluto resulta ser mucho más elevada que la de solvente.
- Diluidas: en esta clase de solución, a diferencia de la anterior, el porcentaje de soluto que la conforma es menor que el de solvente. En estos casos, la diferencia entre ambas resulta ser bastante significativo.
- Saturadas: esta clase de sustancias se caracteriza por el hecho de no poder disolver más soluto estando a cierta temperatura. Si se sobrepasa esta proporción, el resto del soluto quedará en el fondo del recipiente en el que se encuentre la sustancia, sin poder mezclarse.
- Insaturadas: a diferencia de las sustancias anteriores, en estas no existe una proporción de soluto que supere las proporciones máximas para saturar al solvente encontrándose en una determinada temperatura o presión.
- Concentrada: en este caso, si bien se hace presente un porcentaje significativo de soluto, este no es el suficiente como para saturar a la solución.
- Sobresaturadas: en este caso, la cantidad de soluto que se encuentra en la solución es mayor de la que el solvente puede soportar a cierta temperatura. La sobresaturación es la consecuencia de descompresiones hechas de manera precipitada o bien, ante cambios de temperatura muy marcados.
- Debido a este efecto, las soluciones sobresaturadas se preparan de las soluciones saturadas caliente, en las cuales se logro, a una nueva temperatura disolver más soluto. Se tiene cuidado de no enfriar bruscamente la solución saturada para que la sustancia en exceso no cristalice. ejemplo: solución de cloruro de sodio,
SOLUCIÓN SATURADA:
Es aquella solución que no disuelve más soluto; es decir la solubilidad de soluto llego a su límite, esta solución se encuentra en un equilibrio dinámico. ej: solución de cloruro de sodio, dicromato de potasio, hidróxido de potasio. o también Ejemplo: una disolución acuosa saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 ºC.
SOLUCIÓN SOBRESATURADA:
Contiene mayor cantidad de soluto que la solución saturada; este se pudo disolver en la solución a una temperatura superior a la solución saturada.
La solubilidad de las substancias, depende entre otros factores, de la temperatura, como consecuencia disminuye la solubilidad y la sustancia puede, por ejemplo, separarse por cristalización.
